2. 山西医科大学 山西太原 030000
摘要: 目的 探讨CT三维可视化影像重建在输尿管尿路上皮癌手术中的应用价值。方法 回顾性选择于2020年1月至2023年1月入住吕梁市人民医院并接受手术治疗的输尿管尿路上皮癌患者22例,患者术前均行泌尿系统的平扫+增强CT扫描,并采用三维可视化影像重建生成模拟三维图像。通过观察测量模拟的泌尿系三维图像,分析计算肿瘤所在位置、长宽高及大小体积、及其与周围毗邻脏器的关系,并为每例患者制定个性化手术方案,进行模拟手术过程。记录分析患者的一般情况、对比模拟手术过程与实际手术过程的异同点、肿瘤完整切除情况、肿瘤长度(cm)、手术时间(min)、术中出血量(ml)、术后住院时间(d)、TNM分期病理检查结果、术后并发症发生率等指标。结果 22例患者术前均完成了肿瘤的CT三维重建模型,清晰显示肿瘤位置大小,解剖毗邻关系。术前模拟手术过程与术中实际手术过程符合比例为22/22。22例患者均实现肿瘤完整切除,切除的病灶中位长度为4.3(2.4,9.1)cm, 中位手术时间为 109(89,143) min,中位术中出血量 200(150,650)mL,中位术后住院时间为6(5,7)d。结论 CT三维可视化影像重建在输尿管尿路上皮癌手术前可以准确显示肿瘤大小位置及其解剖毗邻关系,并可术前模拟手术过程,术中指导手术进程,可提高手术的安全性,增加治疗效果,值得进一步推广和应用。
关键词:输尿管肿瘤;尿路上皮癌;CT三维重建;手术应用
尿路上皮癌(urothelial carcinoma,UC)是常见的恶性肿瘤,起源于泌尿道上皮内膜、肾盂肾盏系统,为中国十大常见肿瘤之一[1]。尿路上皮癌分为:膀胱癌、肾盂癌、输尿管癌和尿道癌,其中尤以输尿管癌临床症状不明显,恶性程度高,转移率高,晚期输尿管癌患者的5年生存率低于10%[2]。手术完整切除肿瘤是输尿管尿路上皮癌唯一潜在的治愈机会。但输尿管肿瘤因血供较丰富、与周围组织脏器关系复杂,常使术中位置多变,难以判断范围以至于手术复杂度难度提升[3]。全面了解肿瘤大小、位置以及与周围血管毗邻脏器关系是使手术成功的重中之重。基于CT的三维可视化重建技术可具象化呈现肿瘤的大小位置与血管毗邻脏器的空间位置关系,能为外科医师提供术前肿瘤及周围解剖三维图像,其合理应用为提升手术的安全可行性降低手术难度提供帮助[4]。为提高输尿管尿路上皮癌患者的手术成功率,我们对住院治疗的22例输尿管尿路上皮癌患者术前行CT三维可视化分析,评估肿瘤情况并实施模拟手术,将模拟手术情况与实际手术情况对比,探讨CT三维可视化影像重建在输尿管尿路上皮癌手术中的应用价值[5]。
1资料与方法
1.1临床资料 回顾并且筛选于2020年1月至2023年1月间因输尿管肿瘤而入住吕梁市人民医院的患者,共22例输尿管尿路上皮癌患者的临床资料,其中男性14例,女性8例;年龄中位数为52 (35,69)岁;BMI中位数为22.4 (21.1,24.6) kg/m2;其中肿瘤位于左侧10例,右侧12例,临床症状方面 : 因无痛性全程肉眼血尿就诊患者11例, 因患侧腰痛症状就诊患者5例,因查体发者6例。入院后均予腹部B超 、泌尿系CT平扫+增强等检查 ,排除淋巴结转移以及远处转移。6例患者合并有高血压病,3例合并糖尿病,1例合并脑梗死后遗症。纳入标准: ①依据影像学检查诊断为单侧输尿管肿瘤患者;②神志清楚,自愿要求手术治疗;③同意签署手术知情同意书及医疗记录用于教学科研同意书。排除标准:①严重凝血功能障碍或心脑肺肝肾功能不全;②合并有其他严重的内科疾病;③合并有肾脏相关疾病、泌尿系感染等疾病;④全身多发远处转移;⑤输尿管转移性疾病除外。
1.2研究方法
1.2.1进行CT三维可视化模型重建并分析
利用精准手术三维可视化诊疗、分析、计划评估系统将每个患者的原始CT的二维图像资料进行图像的分析、融合、计算、分割和修饰来构建肾输尿管以及膀胱的三维影像学解剖模型,三维角度观察肿瘤的大小、位置,其与周围血管以及毗邻器官的解剖联系。可视化图像见图一。三维可视化分析对于CT图像的基本要求为:(1)平扫 + 增强扫描(动脉期、静脉期)+延迟期;(2)层厚 ≤ 2mm;特殊要求:评估占位可见细小血管侵犯情况,需提供层厚≤1mm 的图像数据。
1.2.2制定手术计划
手术者依据CT及三维可视化分析数据图像制定手术方案,主要原则为:肉眼完整切除肿瘤 (肾输尿管全长切除),靠近膀胱处的肿瘤依据情况施行不同程度范围的膀胱切除。根据肿瘤的CT三维重建结果细致观察,确定肿瘤位置、大小、与周围组织器官的毗邻关系,切除范围、风险及应对方案,演练计划手术方案,根据计算测量的结果进行模拟手术并改善进而确定最终手术方案。
1.2.3手术方法
典型病例:患者,男,54岁,左侧输尿管占位性病变。患者采取全身麻醉,麻妥后,患者取膀胱截石位,会阴部消毒铺无菌单。经尿道置入等离子电切镜,观察膀胱黏膜光滑无肿瘤,双侧输尿管口清晰可见,未见输尿管口喷血,距输尿管口周围约1.0cm处,将左侧输尿管口用针状电极电切至膀胱外,向外推剥输尿管。退出电切镜,留置F16尿管。患者取右侧卧位,腰部垫高。常规消毒铺无菌单于左侧髂前上棘上方2.0cm处切一小口,长约3.0cm,切开皮肤皮下组织,用长弯钳分离腰部筋膜后伸入一示指扩张后腹腔,尽量将腹膜推开,用自制水囊放入后注水空气500ml,停留5分钟。于腋前后线肋下切口处分别置入10mm、5mmTrocar,置入腹腔镜,缝合肌层及皮肤。将腹膜外脂肪分离,切开肾周筋膜,分离肾周脂肪囊,用超声刀逐渐分离肾脏前后上下极及内外侧,用Hem-o-lock钳分别三重结扎肾动静脉。切除肾脏。沿左侧输尿管向下游离,见左肾输尿管上段内可触及肿瘤,约2.0×1.5cm,继续向下游离左侧输尿管至输尿管下段。拔除各套管放出二氧碳气体。左侧腰部切口长约10.0cm,继续向下游离左侧输尿管至膀胱入口处,切断输尿管,取出左肾及输尿管,送病理检查。检查无活动性出血,无腹膜损伤,左侧肾窝留置番式引流管接引流袋。缝合各切口。术毕。手术顺利,麻醉满意,出血约200ml,未输血,患者安返病房。术后所有患者均进行膀胱灌药,使用吡柔比星50mg经尿管灌注。
1.3观察指标
记录分析患者的一般情况、对比模拟手术过程与实际手术过程的异同点、肿瘤完整切除情况、肿瘤长度(cm)、手术时间(min)、术中出血量(ml)、术后住院时间(d)、病理检查结果、术后并发症发生率等指标。
1.4统计学处理
所有记录数据采用 SPSS25.0 进行统计学分析,计量资料采用中位数M(QL,QU)表示,计数资料采用(n)表示。
2结果
2.1术前CT三维可视化分析
22例患者均完成术前CT三维可视化三维重建,其中左侧肿瘤10例,右侧肿瘤12例,肿瘤位于肾盂输尿管连接部7例,输尿管上段4例,输尿管下端5例,输尿管膀胱连接部6例,结果均与术中实际所见一致。CT三维可视化三维重建图像清晰显示肿瘤位置,大小长短及其与周围脏器的毗邻关系,可在术前全方位分析肿瘤的实际解剖情况,制定个体化手术切除方案。经过术前综合评估,11例实行经尿道输尿管口电灼术+后腹腔镜下肾输尿管全长切除手术,5例实行肾输尿管全长切除+膀胱袖状切除术,以及6例依据三维图像个体化扩大切除膀胱。术前模拟手术的计划方案与实际手术过程符合比例为22/22。
2.2手术观察指标分析
患者的一般情况、对比模拟手术过程与实际手术过程的异同点、肿瘤完整切除情况、肿瘤长度(cm)、手术时间(min)、术中出血量(ml)、术后引流量(ml)、术后住院时间(d)、病理检查结果、术后并发症发生率22例患者均实现肿瘤完整切除,其中11例均实行肾输尿管全长切除+输尿管口电灼术,5例膀胱袖状切除,6例膀胱扩大切除。切除的肿瘤中位长度为4.3(2.4,9.1)cm, 中位手术时间为 109(89,143) min,中位术中出血量 200(150,650)mL,中位术后住院时间为6(5,7)d。 术后病理检查结果:均为尿路上皮癌。13例患者手术详情见表1。无围手术期死病例,无大出血、肾功能衰竭等严重并发症发生。以模拟手术数据为实验组,实际手术数据为对照组进行对比分析,见表1。
表1模拟手术数据与实际手术数据对比
实验组 | 对照组 | p | |
肿瘤长度(cm) | 4.9(2.6,9.6) | 4.3(2.4,9.1) | 0.143 |
手术时间(min) | 105(70,120) | 109(89,143) | 0.124 |
术中出血量(ml) | 200(120,500) | 200(150,650) | 0.176 |
术后住院时间(d) | 6(5,7) | 6(5,7) | 0.151 |
两组数据对比,差异无统计学意义。
2.3术后随访情况
随访至2023年9月,全组患者随访时间3~19个月,其中有两例患者发生膀胱肿瘤复发,予以多次经尿道膀胱肿瘤电切术。
2.4病例探讨
患者韩X,女,65岁,主因“左侧腰背部困痛不适1月”入院。泌尿系彩超:左肾中度积水伴左侧输尿管中上段扩张。入院初步诊断为:左肾积水。膀胱镜检查:左侧输尿管口可见大小约1.0*0.8cm菜花状肿物,触之易出血。CT提示:左侧输尿管末端内可见软组织密度影,CT值33Hu,增强扫描后可见强化,此水平以上输尿管扩张,左侧肾盂、肾盏扩张,内见水样密度影,肾皮质变薄。考虑左侧输尿管端占位性病变伴左肾积水及输尿管扩张。诊断:左侧输尿管末端占位、左肾积水。术前CT影像学检查图像及三维可视化重建图像如下:



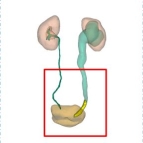
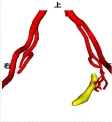
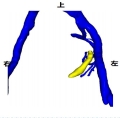
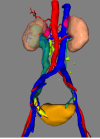

经过数据分析及病理诊断,该患者实行经尿道输尿管口电灼术+后腹腔镜下左肾输尿管全长切除手术,与术前CT三维影像学分析相符合,手术用时3小时25分钟,术中出血量约200ml,术后病理结果:左输尿管低级别尿路上皮乳头状癌。肿物侵及肌层,未见脉管、神经侵犯,输尿管断端(-),肾门血管断端(-),肾乳头、肾皮质、髓质(-)。PTNM:P1aN0M0。术后无并发症发生。
3讨论
输尿管尿路上皮癌是指起源于输尿管尿路上皮的恶性肿瘤。而起源于肾盂和输尿管的尿路上皮恶性肿瘤统称为上尿路尿路上皮癌(UTUC)。上尿路尿路上皮癌占尿路上皮癌(UC)的 5-10%。输尿管癌和膀胱癌的形态学相似,并且几乎所有的输尿管癌都起源于尿路上皮[6-7]。而在中国人患有UTUC 的概率占所有 UC 的比例为 9.3%-29.9%,平均 17.9%,相比于其他国家有着更高的比例[8]。与其他国家相比,中国人患输尿管癌在流行病学上有着不同的特点:在中国,所有输尿管癌患者中女性更加常见,男女比例为 1:1.3[9-10]。输尿管癌的高发年龄段为 70-90 岁,而且约 60%输尿管癌为浸润性肿瘤[11]。根据危险度分级输尿管癌可分为低危和高危。低危输尿管癌为肿瘤<2cm、低级别 UC、CT 尿路造影(CTU)提示为非侵袭性肿瘤。而高危输尿管癌为多发病灶、并发肾积水、肿瘤≥2cm、高级别 UC、CTU 提示具有侵袭性、有高级别膀胱癌行根治手术史、变异的组织学类型[12]。输尿管癌首选治疗方式是外科治疗,包括根治性肾输尿管切除术(RNU)、保肾手术、淋巴结清扫术、减瘤性手术,及术后辅助治疗和随访。根据目前的诊断治疗指南,多数专家建议将根治性的肾、输尿管切除术加袖套状膀胱壁切除术作为高危非转移性上尿路上皮癌的标准术式,其切除范围为肾、输尿管包括输尿管口入膀胱处12而对于输尿管下端以及输尿管膀胱连接部的肿瘤切除范围关乎患者的生存预后,由于输尿管尿路上皮癌早期症状隐匿,大部分患者确诊时肿瘤体积增大,堵塞输尿管导致肾盂积水、向上侵犯肾盂,向下侵犯膀胱,向周围侵犯其他器官组织,切除范围难以确定,手术难度增大。术前明确输尿管尿路上皮癌肿瘤的位置,大小与周围组织脏器的解剖关系,对于指导手术方案、降低手术风险及获得良好的预后具有重要意义。本组病例中输尿管肿瘤的位置多变,侵犯程度不一,需要每位患者制定个体化的切除方案,而基于CT的三维可视化影像重建图像可以将CT2维数据通过系统变为3维立体图像,而且可供临床医生测量肿瘤的大小,明确肿瘤具体位置,周围动静脉连接情况,还可以拆分旋转切割模拟手术过程,为手术方案提前进行演练,提前发现异常血管,规避风险,保证手术安全,增强手术疗效,提高手术的安全性和准确性[13]。不仅如此在术前与患者及其家属沟通时,利用三维图像有助于患者及其家属更好的理解手术过程,增强医患信任感,而且在教授医学生时,也更加的一目了然,提高学生们的学习效率,增加学习兴趣。综上所述,本文回顾性分析了22例输尿管尿路上皮癌患者的临床资料,将术前模拟手术情况与实际手术情况对比,在输尿管尿路上皮癌外科手术治疗方面,CT三维可视化重建与分析可精准展现肿瘤的大小位置,供应动脉与静脉,侵犯周围脏器情况,为腹腔镜手术提供了有效的模拟手术,演练方案,有助于手术规划,精准切除,医患交流以及学生教学,应用前景广阔,值得进一步研究推广。
参考文献:
1陈美元,沈宏亮,佟昕,张东兴,刘文辉,韩威,邹胜磊,王翔宇,肖荆.替雷利珠单抗治疗局部晚期或转移性尿路上皮癌的疗效和安全性分析[J].癌症进展,2022,20(20):2095-2097+2101.
[2] Tran L,Xiao JF,Agarwal N,et al. Advances in bladder cancer biology and therapy[J]. Nat Rev Cancer,2021,21(2):104-121.
[3]SMITH H G,THOMAS J M,SMITH M J,et al.Multivisceral resection of retroperitoneal sarcomas in the elderly[J].Euro JCancer,2016,69:119-126.
[4]LEE N.The lancet technology:三维 printing for instruments,models,and organs?[J].Lancet (London,England),2016,388(10052):1368.
[5]林佳鑫,刁德昌,廖伟林,汪佳豪,李洪明,易小江,卢新泉,冯晓创,陈昭宇.CT三维重建及三维打印技术在复杂的腹膜后肿瘤手术中的应用[J].结直肠肛门外科,2022,28(02):119-123.DOI:10.19668/j.cnki.issn1674-0491.2022.02.004
[6]林泽欣.输尿管尿路上皮癌预后因素分析及预测模型构建[D].汕头大学,2022.
[7]李俊伍,张元峰,李家兴,李钦轲,张荣贵.经腹腔与经腹膜后腹腔镜治疗上尿路尿路上皮癌疗效对比的meta分析[J].现代医药卫生,2022,38(05):775-778.
[8]许永德,吉正国,胡新一,杨培谦.上尿路尿路上皮癌:应重视的恶性肿瘤[J].中国医刊,2021,56(06):581-584+576.
[9]尚义超,尚攀峰.上尿路上皮癌根治术中淋巴结清扫研究进展[J].中国肿瘤临床,2020,47(24):1293-1296.
[10]叶云林.上尿路尿路上皮癌外科治疗中国专家共识[J].现代泌尿外科杂志,2018,23(11):826-829.
[11]王逸夫,安瑞华,郭桂迎,于时良,刘亚东.影响输尿管移行细胞癌患者预后的术前因素[J].现代泌尿外科杂志,2018,23(04):274-278.
[12]LI S,PAN Y,HU J.Oncologic outcomes comparison of partial ureterectomy and radical nephroureterectomy for urothelial carcinoma[J].BMC Urol,2019,19(1):120.
[13]贺健康,刘亚雄,连芩,王玲,靳忠民,李涤尘.面向重要实质器官的生物制造技术[J].中国生物工程杂志,2012,32(09):76-81.DOI:10.13523/j.cb.20120912