(空军军医大学第二附属医院检验科 陕西 西安 710038)
[摘要] 目的:检测不同浓度5-FU对人肝癌细胞HepG2增殖抑制和克隆形成能力的影响。方法:CCK8实验检测不同浓度5-FU对人肝癌细胞HepG2增殖抑制能力,克隆形成实验检测不同浓度5-FU对HepG2细胞克隆形成能力的影响。利用流式细胞术检测不同浓度5-FU对HepG2细胞凋亡的影响。结果:CCK8和克隆形成结果均显示5-FU可抑制HepG2细胞的增殖,且随着浓度增大抑制效果明显。高浓度5-FU可使HepG2细胞凋亡增加。结论:5-FU对人肝癌细胞HepG2增殖和克隆形成具有较强的抑制作用。
[关键词]:肝癌;5-FU;细胞增殖
前言
肝癌是全世界常见的消化道恶性肿瘤,主要是由肝细胞和肝内胆管上皮细胞发生的恶性肿瘤[1],近年来发病率呈上升趋势,具有复发率高,预后不良的特点[2,3],目前对肝癌的治疗方法较多,主要为放化疗,生物及中西医结合治疗。5-氟尿嘧啶(5-fluorouracil,5-FU)是临床常见的化疗药物,通过干扰核酸的合成来抑制肿瘤细胞增殖,是具有细胞周期特异性的细胞毒类抗癌药物[4]。已在临床使用较长时间,随着临床化疗的进行,出现的副作用也较多[5],本实验主要研究在一定剂量范围内,不同浓度5-FU对肝癌细胞增殖的作用机制。
1材料与方法
1.1材料
人肝癌细胞HepG2,为本实验室保存。小牛血清购自杭州四季青公司,DMEM培养液购自Invitrogen公司。CCK8细胞增殖检测试剂盒和细胞周期检测试剂盒购自江苏凯基生物公司。其他生化试剂均为进口或国产分析纯试剂。5-氟尿嘧啶购自天津金耀氨基酸有限公司(批号:1803091)。
1.2仪器
IX71倒置显微镜(日本奥林巴斯株式会社),Epoch超微量分光光度计(美国BIO-TEK公司),Calibur流式细胞仪(美国BD公司)。
1.3 细胞培养
HepG2细胞,含10%小牛血清,1%青/链霉素的高糖DMEM培养液,于37℃、5%CO2培养箱中培养。0.25%的胰酶消化传代。
1.4 CCK-8检测细胞增殖
取对数生长期的HepG2细胞接种,0.25%的胰酶消化,1000rpm,5min离心收集细胞,调整细胞浓度至2×104/mL,接种细胞至96孔板中,100 µL/孔。37℃、5%CO2培养24h,待细胞贴壁后,吸弃培养液,加入含5-FU的DMEM无血清培养液至浓度分别为0,5,15,25,50µg/mL。每组设置6个复孔,分别培养0h,24h,48 h和72h,每孔加入10µL的CCK8,继续培养4h,检测450nm吸光值。相对增殖速率=OD实验组/OD对照组×100%。
1.5细胞克隆形成实验
取对数生长期的HepG2细胞,接种200个细胞至10cm培养皿中,37℃、5%CO2培养24h,待细胞贴壁后,吸弃培养液,加入含5-FU的DMEM 10%小牛血清培养液至浓度分别为0,5,15,25,50µg/mL,培养15天,吸弃培养液,PBS洗三次,75%乙醇固定15min,加入1mL结晶紫染液,染色10 min。流水冲洗至背景干净,室温晾干,观察计数。
1.6细胞凋亡检测
接种HepG2细胞至6孔板中,2×105个细胞/孔,37℃、5%CO2培养24h,待细胞贴壁后,吸弃培养液,加入含5-FU的DMEM 10%小牛血清培养液至浓度分别为0,5,15,25,50µg/mL,培养48h后,采用无EDTA的胰酶消化收集细胞,PBS洗涤细胞2次,加入500 L的Binding Buffer重悬细胞,分别加入5 L Annexin V-FITC与5 LPI,混匀,室温避光反应5-15 min,流式细胞仪检测。
1.7 统计学处理
采用SPSS22.0 统计学软件,两组间比较采用独立样本t检验;P < 0.05 表示差异有统计学意义。
2结果
2.1 5-FU对HepG2细胞的生长增殖抑制作用
CCK8细胞增殖实验结果显示随着5-FU浓度增加细胞增殖速率逐渐降低(图1),表明5-FU对HepG2细胞的增殖有抑制作用。

图1 CCK8实验检测细胞增殖能力,* P<0.05
2.25-FU抑制HepG2细胞克隆形成
克隆形成实验结果显示(图2),经过相同条件的培养后,高浓度5-FU的细胞克隆数目低于低浓度5-FU的细胞克隆,表明5-FU对HepG2细胞的增殖有抑制作用。

图2 不同浓度5-FU对细胞克隆形成的影响,*P<0.05
2.3 5-FU对细胞凋亡的作用
流式细胞术分析结果发现(图3)5-FU处理HepG2细胞48 h,可诱导HepG2发生凋亡,凋亡细胞比率随DHA处理浓度的升高而提高。
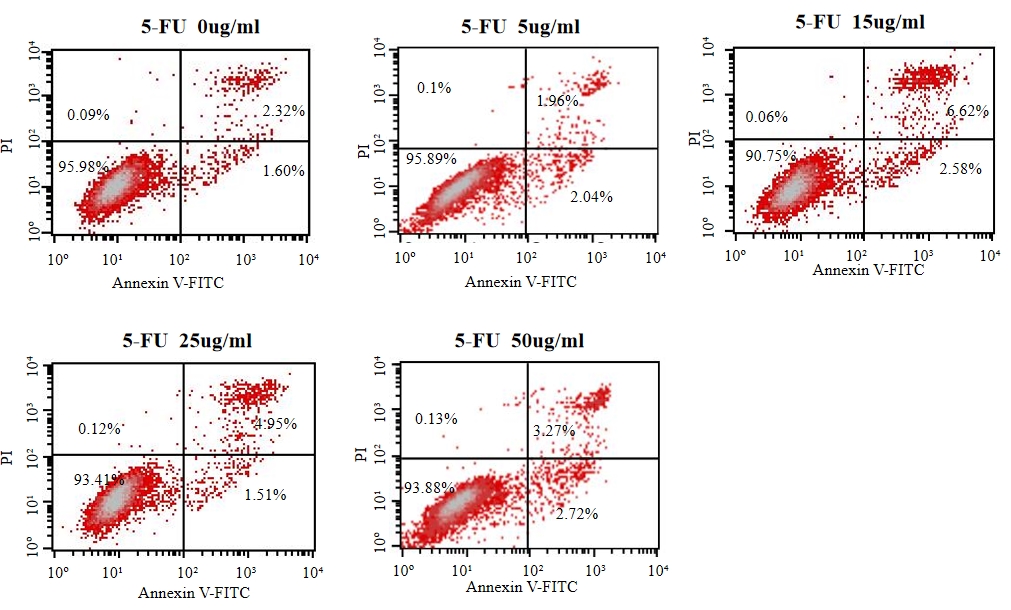
图3 流式细胞仪检测细胞凋亡
3讨论
肝癌的发生是一个多因素、多步骤的复杂过程,其治疗难度大,预后差,一直是临床上面临的重大难题和挑战。其主要因素是肝癌细胞的侵袭和转移能力[6]。5-FU作为抗肿瘤药物已广泛应用于各种实体肿瘤的治疗,如大肠癌、胰腺癌、乳腺癌、头颈部肿瘤、胃癌和卵巢癌等,目前已成为消化道恶性肿瘤普遍使用的化疗药物。今年来,随着科研工作的深入研究,其抗肿瘤的机制也备受瞩目。5-FU是抗嘧啶类抗代谢药物,Matheson[7]在动物体内证明其具有增强NK细胞杀伤肿瘤细胞的能力。郭亚军[8]等在肝癌小鼠模型中也发现低剂量5-FU能抑制Ts细胞,有利于肿瘤所引起的免疫抑制的解除,与免疫增强剂呈显著协同作用。
当前临床已有很多资料表明,5-FU在杀伤肿瘤细胞的同时也对正常细胞造成损伤,其副作用在临床不可忽视[9.10]。本课题主要研究体外低剂量5-FU对肝癌细胞HepG2的增殖抑制,发现在一定剂量范围内,随着5-FU浓度的增加,肝癌细胞增殖抑制作用越明显,增殖与剂量呈负相关。课题主要研究体外实验,对于联合药物治疗及体内实验后续会进一步研究,更深入探讨5-FU 的抗肿瘤机制。
参考文献(References)
王惠,徐陆周,吴坚,等.理冲汤加减联合5-氟尿嘧啶对人肝癌细HepG2上皮间质转化的影响[J].中国实验方剂学杂志,2019,25(7):14-21..
Venook AP, Papandreou C, Furuse J, de Guevara LL. The incidence and epidemiology of hepatocellular carcinoma: a global and regional perspective. Oncologist. 2010;15 Suppl 4:5-13. doi:10.1634/theoncologist.2010-S4-05.
彭慧,郑莹,彭鹏,等.上海市人群2002-2006年肝癌生存率分析[J].中国癌症杂志,2016,26(7):561-568
唐晓丽,杨霖,杨依,等.5-氟尿嘧啶联合机械划伤致金黄地鼠口腔黏膜炎模型的建立[J].中国比较医学杂志,2019,29(1):29-34
张小年,张洁文,吴绍锋,等.淫羊藿苷对5-氟尿嘧啶诱导的大鼠骨髓间充质干细胞损伤的保护作用[J].中国药理学通报,2020,36(5):675-681
殷晓丽,刘兆玉.上皮间质转化在肿瘤中的研究进展[J].医学综述,2017,23(12):2359-2363,2369
Matheson DS, Green B, Hoar DI. The influence of methotrexate and thymidine on the human natural killer cell function in vitro. J Immunol. 1983;131(4):1619-1621.
郭亚军,等.肝癌太鼠T细胞亚群变化和免斑疗法俸内抗 肿瘤作用第二军医大学学报,1988}9(5)t 401~406
赵敬,赵涌.姜黄素对人宫颈癌细胞株HeLa细胞抑制及凋亡的影响[J].重庆医科大学学报,2004,29(3):296-298.
冬毕毕,周军民,陈凯,等.氟尿嘧啶对结肠癌细胞凋亡及Rb蛋白表达的影响.癌症,2000,19(5):439-441