1. 四川轻化工大学 生物工程学院 宜宾 644000 2. 四川轻化工大学 材料科学与工程学院 自贡 643000
摘要:乙醇俗称酒精,其应用十分广泛,可以作为白酒勾兑、香精、燃料、饮料等制造原料,在生物学中可以作为溶剂、萃取剂等,并且在医疗消毒方面也起着重要作用。乙醇应用与其分子几何结构、电子结构以及分子结合能密不可分。本文借助软件materials studio,对乙醇进行了几何结构优化,乙醇分子结合能以及乙醇电子结构计算从而对乙醇研究提供了有价值的参考。
关键词:乙醇、几何结构、结合能、电子结构
1、引言
乙醇是一种在常温常压下容易挥发、燃烧的无色透明液体, C、H、O是构成乙醇分子的3种原子,其分子式为C2H6O[1]。可以把乙醇看成是乙烷分子中的一个氢原子被羟基取代的产物,也可以看成是水分子中的一个氢原子被乙基取代的产物[2]。因为乙醇作为食用酒精有微甘并带有刺激的辛辣滋味的特点,使其成为中国白酒中的最主要的成分。
乙醇的分子结构、物理、化学性质以及其生物学研究一直备受关注,前人对于乙醇进行了非常多深入研究,例如管思阳[3]对乙醇-水溶液的拉曼光谱与分子结构进行分析,其实验结果为有关水分子和醇类分子团簇结构的理论和应用研究提供了有价值的参考。王涛[4]等进行了乙醇废水的超临界水氧化处理工艺研究,通过实验发现一氧化碳和二氧化碳分别是反应中间产物和最终产物,550℃、25MPa、停留时间大于15s时,超临界水氧化处理能将乙醇完全氧化为二氧化碳。
虽然前人已经对乙醇进行了许多深入的研究,但是对于乙醇的几何结构优化、乙醇的结合能计算、乙醇的电子结构方面研究还存在诸多疑问,本文针对上述问题进行了更进一步的探究。
2、计算模型及计算参数
乙醇分子式为C2H6O,本文通过软件materials studio先建立了一个3D模型,然后添加2个碳原子,并对这2个碳原子进行了氢原子填充,删除了一个碳原子上的氢原子后在此添加了一个氧原子,最后对氧原子进行了氢原子填充,完成了乙醇球棍模型的建立。结合能是指原子或更小的微粒结合成较大微粒时释放出的能量,能够表明乙醇分子结合过程中放出的能量,通过结合能计算公式E(结合能) = E(C)+E(H)+E(O)-E进行计算。E(结合能)表示乙醇分子的结合能,E(C)表示碳原子的总能量,E(H)表示氢原子的总能量,E(O)表示氧原子的总能量,E表示乙醇分子的总能量。
本文首先建立了乙醇球棍模型,然后通过软件materials studio对其进行了几何结构优化,完毕后又对乙醇分子能量进行计算,最后对乙醇分子进行了原子与化学键布局分析。本文系统的能量和电子结构采用基于密度泛函理论的CASTEP模块计算完成。电子交换相关泛函选用GGA近似。平面波使用超软质势,截断能选择350 eV,确保能量收敛到1x10-5 eV/atom布里渊区使Monkhorst--Pack点网格取样,几何优化时,驰豫到每个原子间力小于0.03 eV/Å,每个原子的位移小于0.001Å.为了改善收敛速度,拖尾参数设置为0.01 eV。
3、结果与讨论
3.1 乙醇分子几何结构优化
建立乙醇分子球棍模型,分子式为C2H6O,已搜索到其稳定的形态结构,如图1所示。通过软件materials studio对其进行几何优化计算,计算结果为图1所示。通过图1所示计算结果可知,乙醇分子中碳-碳键长为0.15 nm,左边甲基中碳-氢键长为0.11 nm,右上角羟基中氧-氢键长为0.096 nm,右上角碳-氧键长为0.14 nm。右下角乙基中碳-氢键长为0.11 nm。此外通过对各个原子之间角度测量得出右上角氢-碳-氢的角度为107.22°,右下角氢-碳-氢角度为107.73°,左边氢-碳-氢角度为108.39°。本文中对乙醇分子几何结构优化计算结果与实验结果相同,说明了本文的计算结果有效。
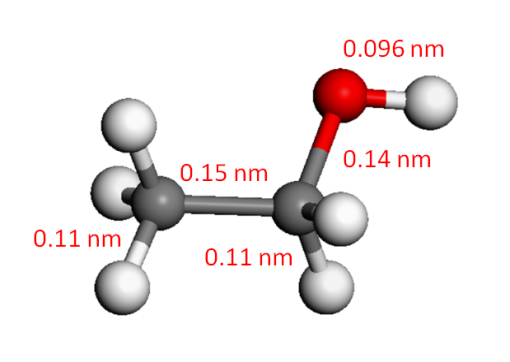
图1 乙醇分子几何结构优化结果
3.2 乙醇分子结合能计算
乙醇分子结构优化完毕后,通过软件对乙醇分子进行能量计算,计算过程为首先计算乙醇分子总能量,单个乙醇分子总能量计算结果为-842.69 eV,然后分别计算单个碳原子,氢原子,氧原子的总能量分别为单个碳原子为-145.57 eV、单个氢原子的能量为-12.35 eV,单个氧原子的能量为-427.85 eV。根据结合能计算公式, 将计算数据代入结合能计算公式中,得到乙醇的结合能为61.97 eV。表明了乙醇分子结合过程中放出的能量为61.97 eV。
3.3 乙醇分子电子结构计算
为了进一步研究乙醇分子在形成过程中的电荷在原子之间的转移状态,对分子进行了原子与化学键布局分析,计算结果如图2所示。由图可知,乙醇分子中左边碳原子总电子数目为4.82,右边碳原子总电子数目为4.30,氧原子的总电子数目为0.678,与氧相连的氢原子总电子数目为0.48,与碳相连的氢原子总失电子数目为0.73.相比于左边碳原子只与3个氢原子相连,右边碳原子与2个氢原子和1个氧原子,氧原子会夺得碳原子原本该获得的电子,导致左边碳原子总电子数大于右边碳原子。
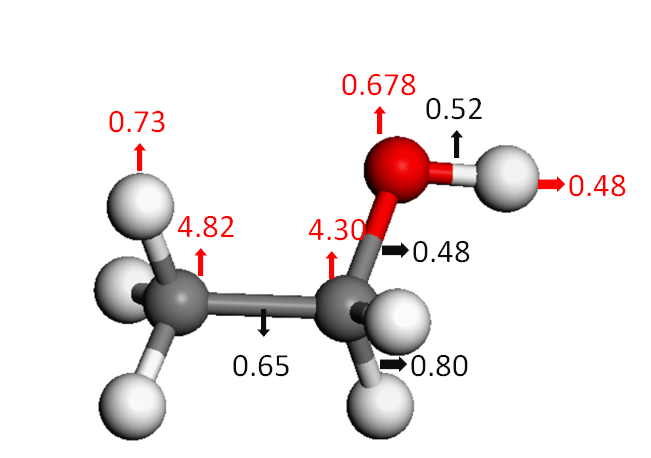
图2 乙醇分子的电子结构计算
乙醇分子化学键上的电子数目计算结果表明碳-碳键上的电子数目为0.65,碳-氧键上的电子数目为0.48,氧-氢键上的电子数目为0.52,碳氢键上的电子数目为0.80。
4、小结
本文通过软件materials studio对乙醇分子的几何结构优化、乙醇结合能、乙醇电子结构进行计算,通过计算得到了乙醇分子的几何结构,包括键长、键角。结合能计算结果表明在由原子组成乙醇分子过程中,为放热反应,放出热量为61.97 eV,此外,电子结构计算结果表明乙醇分子中主要为碳原子得到电子,氢原子失去电子,化学键布局数显示原子公用电子主要集中在碳-碳键和碳-氧键之间,以上研究结果对深化乙醇分子认知具有一定指导意义。
5、参考文献
[1]沈鑫甫.中学教师实用化学辞典[M].北京:北京科学技术出版社,2002:258-259.
[2]秦浩正.中学生学习辞典 (化学卷)[M].上海:世界图书上海出版公司,2012:329-330.
[3]王涛. 乙醇废水的超临界水氧化处理工艺研究. 环境科学学报, 2002:1(2),17-20.
[4]管思洋. 乙醇-水溶液的拉曼光谱与分子结构. 硕士, 南京大学, 2010.
2