云南白药集团股份有限公司,云南昆明 650500
摘要:进入无菌区的物品均应无菌化,目前行业内,多采用湿热灭菌法(脉动真空灭菌柜)对无菌区洁净服、工器具、器皿、灌注器、清洁工具等进行灭菌。湿热灭菌法是指物品在灭菌器内利用高压蒸汽杀灭微生物,具有穿透能力强、传导快、无残留、灭菌能力强等优点。本文主要介绍脉动真空灭菌柜的验证方法及灭菌效果监测。
关键词:脉动真空灭菌柜,湿热灭菌,灭菌效果;
最终灭菌物品中的微生物存活概率(即无菌保证水平,SAL)不得高于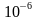 ,根据物品的微生物污染水平和耐受湿热的能力不同,湿热灭菌程序通常分为过度杀灭法和残存概率
,根据物品的微生物污染水平和耐受湿热的能力不同,湿热灭菌程序通常分为过度杀灭法和残存概率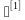 ,需灭菌物品(B级区洁净服、工器具、灌注器、清洁工具)热稳定性较好,故采用过度杀灭法进行灭菌(灭菌程序:121℃、30min),脉动真空灭菌柜在投入使用前或验证到期时,必须进行设备验证(对各灭菌物品进行连续3锅次的空载热分布、负载热分布、热穿透测试),同步采用生物指示剂进行挑战测试。
,需灭菌物品(B级区洁净服、工器具、灌注器、清洁工具)热稳定性较好,故采用过度杀灭法进行灭菌(灭菌程序:121℃、30min),脉动真空灭菌柜在投入使用前或验证到期时,必须进行设备验证(对各灭菌物品进行连续3锅次的空载热分布、负载热分布、热穿透测试),同步采用生物指示剂进行挑战测试。
1 目的
保证脉动真空灭菌柜温度分布均匀性及灭菌效果符合法规要求。
1.1温度分布均匀性验证
1.1.1灭菌温度允许范围:设定温度+0℃~+3℃
1.1.2温度极差:灭菌阶段同一时刻温度最大值与最小值的差值≤2.0℃;
1.2灭菌效果监测
1.2.1累积杀死率F0>12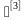
1.2.2生物指示剂挑战测试合格;
2 材料
2.1 生物指示剂:自含式生物指示剂,生产企业:TERRAGENE,含菌量>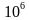 CFU。2.2 仪器仪表:恒温培养箱经过验证、相关仪器仪表经过校验,符合使用要求。
CFU。2.2 仪器仪表:恒温培养箱经过验证、相关仪器仪表经过校验,符合使用要求。
3 温度分布均匀性验证
3.1 验证温度探头、指示剂布点数量、位置
(1)至少选择10个点(较大的灭菌器可以选择15~20个点);
(2)几何中心和角落应有代表性点,冷凝水排水口(低温点);
(3)热穿透测试时,应放置在最难穿透点的灭菌物品中,多种灭菌物品混装时,放置点应具有代表性;
3.2 灭菌物品装载确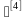
(1)灭菌物品类型:尽可能选择同一类型物品进行灭菌,如:织物(洁净服、毛巾、拖布)、器械(灌注器、清洁工具)等;
(2)装载数量:根据灭菌柜的大小,灭菌物品的形状、种类、生产需求等合理确定灭菌物品的数量,温度验证时需要对最大装载量进行验证;
(3)装载方式:织物采用悬挂式,器械采用平放式、倒置式,各物品之间应留有一定间隙,倒置式便于排出冷凝水;
3.3 测试方法
使用无线温度探头进行温度热分布测试。按温度探头布点数量、位置将温度探头放置于灭菌柜内的相应位置,放置过程中,温度探头不能与灭菌柜腔内金属表面接触,并避免碰撞。完成连续3次空载热分布、负载热分布、热穿透测试(负载、热穿透测试可同时进行,部分温度探头放置于灭菌柜腔室内做负载热分布测试,部分探头放置于灭菌物品内做热穿透测试)。
3.4 测试数据统计
表1 温度分布均匀性测试结果记录表单
| 热分布类型 | 最高温度℃ (121~124℃) | 最低温度℃ (121~124℃) | 温度极差℃ (≤2.0℃) | 最小F0值 (>12) |
| 空载(1) | 122.91 | 121.23 | 0.90 | 37.48 |
| 空载(2) | 123.07 | 121.22 | 0.52 | 37.99 |
| 空载(3) | 122.83 | 121.18 | 1.06 | 37.55 |
| 负载、热穿透(1) | 123.33 | 121.03 | 1.04 | 36.29 |
| 负载、热穿透(2) | 123.18 | 121.12 | 1.43 | 36.53 |
| 负载、热穿透(3) | 123.50 | 121.23 | 1.34 | 36.10 |
4 生物指示剂挑战测试
4.1 测试方法:随负载、热穿透测试过程同步进行,每次放1支阳性对照样品。
4.2 生物指示剂挑战测试结果均合格:灭菌完毕后放于55~62℃培养箱内培养24后观察,指示管不变色(呈紫色),表示灭菌合格;指示管变黄色,表示灭菌不合格。
5 结论
5.1 根据实际灭菌工艺和灭菌物品的受热稳定性不同,可以选择过度杀灭法和残存概率法两种湿热灭菌程
 。
。
5.2 脉动真空灭菌柜在投入使用前或验证到期(验证有效期为1年,设备发生重大变更、改造时),必须进行设备验证,验证合格后方能正常使用。
5.3 温度分布均匀性可接受标准:①灭菌温度允许范围:设定温度+0℃~3℃;
②温度极差:灭菌阶段同一时刻温度最大值与最小值的差值≤2.0℃;当灭菌柜在验证周期内,发生验证状态偏移、改变时,如:设备的控制温度超过允许范围时,应该采取相应的控制措施,并再次进行验证合格后方能使用。
5.4 灭菌效果监测可以采用物理、化学、生物指示剂方法进行监测,判定脉动真空灭菌柜灭菌效果的方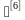 有:①累积杀死率F0>12;②生物指示剂挑战测试合格(含菌量>
有:①累积杀死率F0>12;②生物指示剂挑战测试合格(含菌量>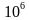 CFU均可)。
CFU均可)。
5.5 验证温度探头及生物指示剂的数量、布点位置选择方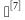 :①通过空载热分布测试确定灭菌柜腔室内不同位置的温差状况,确定可能存在的冷点,对该位置应增加温度探头、生物指示剂布点数量;②热穿透测试时,温度探头、生物指示剂应放置在最难穿透点的灭菌物品中。
:①通过空载热分布测试确定灭菌柜腔室内不同位置的温差状况,确定可能存在的冷点,对该位置应增加温度探头、生物指示剂布点数量;②热穿透测试时,温度探头、生物指示剂应放置在最难穿透点的灭菌物品中。
参考文献
[1]《药品生产质量管理规范》附录1 无菌药品;
[2] GB 8599-2008 大型蒸汽灭菌器技术要求自动控制型;
[3] EN-285(1996)-灭菌-蒸汽灭菌器-大型灭菌器;
[4]杨玮玮.脉动真空灭菌柜最大装载量确定及其验证. 上海新先锋药业有限公司第四制药厂,上海200137.
[5]孟祥云.脉动真空压力灭菌柜灭菌效果的监测与研究.现代护理2002年第8卷第5期.
[6]陈雄.纯蒸汽真空脉动灭菌柜湿热灭菌验证.科技视野.海南皇隆制药股份有限公司,海南 海口 570203.
[7]陈武,胡秀兰.探讨脉动真空压力蒸汽灭菌柜灭菌效果验证方法.武汉生物制品研究有限责任公司,湖北 武汉 430207.